摘要:为建立稳定的胚状体增殖成苗技术体系,以期稳定获得足够的再生植株,以花椰菜小孢子胚状体为试材,研 究了植物生长激素6一BA、NAA对胚状体增殖及再生苗生根培养的影响。结果表明,胚状体在附加1.25 mg‘L。 6.BA+0.025 mg.L’1 NAA的改良MS培养基上培养,增殖系数最高,可达10.3;再生苗在附加浓度为1.0 mg’L。1NAA 生根培养基上的生根效果最佳,平均每芽上生根数达到8.1个。因此,6.BA和NAA配合使用,可显著提高胚状体 增殖系数;生根培养基中,添加适量的NAA可增加再生苗的生根数。
花椰菜(又名菜 花、花菜,椰菜花、芥蓝花、花甘蓝、球花甘蓝;清代 称为番芥蓝,是十字花科芸薹属甘蓝类的蔬菜。花 椰菜食用器官为花球,其营养丰富、风味鲜美、外形 美观,深受广大消费者的喜爱,在农业生产中占有 一定地位,世界各地均有种植,我国各地己普遍栽 培。目前我国己成为世界上花椰菜第一生产大国, 花椰菜在蔬菜周年供应中占有越来越重要的地位。
目前市场上推广的花椰菜品种绝大多数是F1, 采用常规方法从分离纯化亲本,再到测配组合一般 需6~8 a(年),育种时间较长。而游离小孢子培养 技术可以快速获得纯合体,缩短育种年限,既提高 育种效率,同时由小孢子培养获得的胚状体和再生苗还可以广泛应用于遗传图谱构建、基因定位、转 基因育种以及染色体工程等。随着现代生物技术 的飞速发展,人们采用基因转化技术使其获得新型 重要的园艺性状成为了可能,而基因转化工作的 前提就是建立高效的离体再生体系,小孢子胚状体 增殖成苗的数量和质量成为此技术应用上最重要 的环节,笔者旨在建立稳定的胚状体增殖成苗技术 体系,以期稳定获得足够的再生植株,对花椰菜的 遗传育种和转基因应用研究具有重要意义。
1材料与方法
1.1材料供试材料为天津科润蔬菜研究所实验室花椰菜双单倍体材料D1小孢子游离后再分化生长发育 形成的胚状体。试验于2017年4—11月在天津科 润蔬菜研究所实验室进行。
1.2方法
1.2.1 不同激素浓度配比对胚状体增殖的影响 胚状体接种于不同激素浓度配比的改良MS培养基 (NH4NO,减半+0.4%琼脂+3%蔗糖)中,培养基pH 在高压灭菌前调为5.8左右,培养温度为25℃左右, 光照强度为1 600~2 000 1x,每天光照时数为14 h。 100 mL三角瓶中分装25 mL培养基,每瓶接种5 个外植体,在组培架上随机区组排列。以不含激素 的改良MS为对照(CK),培养25 d后观察结果并 记录成苗数量和品质,进行统计分析。
1.2.2 丛生芽生根培养将丛生芽切分成独立的 小苗接种在不同生长素(NAA)的MS培养基(0.4% 琼脂+3%蔗糖)中,培养诱导生根,并形成完整的再 生植株,100Ⅱ1L三角瓶中分装25 mL培养基,每瓶 接种5个外植体,在组培架上随机区组排列。以不 含激素的MS培养基为对照(CK),培养15 d后观 察结果并记录生根情况,进行统计分析。
2结果与分析
2.1不同激素配比对胚状体增殖的影响
由表1可知,在不加激素的情况下,胚状体继 续正常发育生长,但没有再生芽诱导发生。6.BA 和NAA共同使用可显著提高胚状体增殖系数, 1.25 mg·L。1 6一BA+0.025 mg·L-1 NAA处理为本试验 中的最佳激素配比,此时胚状体增殖系数最高,可达10.3,丛生芽的数量多且品质好(图1)。当6一BA 浓度一定时,随着NAA浓度的增加,胚状体愈伤组 织化程度增高,再生根数目增多,NAA的适宜质量 浓度为0.025 mg·L~;当NAA质量浓度一定时,随 6.BA质量浓度的增加,根的再生受到抑制,当6.BA 质量浓度超过1.25 mg·L-l时,芽再生频率下降,且 玻璃化加深,成苗数量和品质下降。
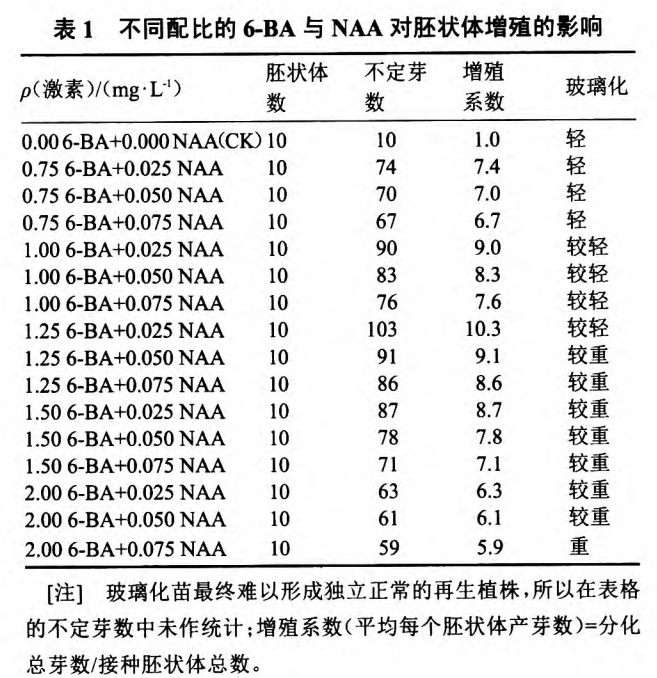
2.2丛生芽分离诱导生根
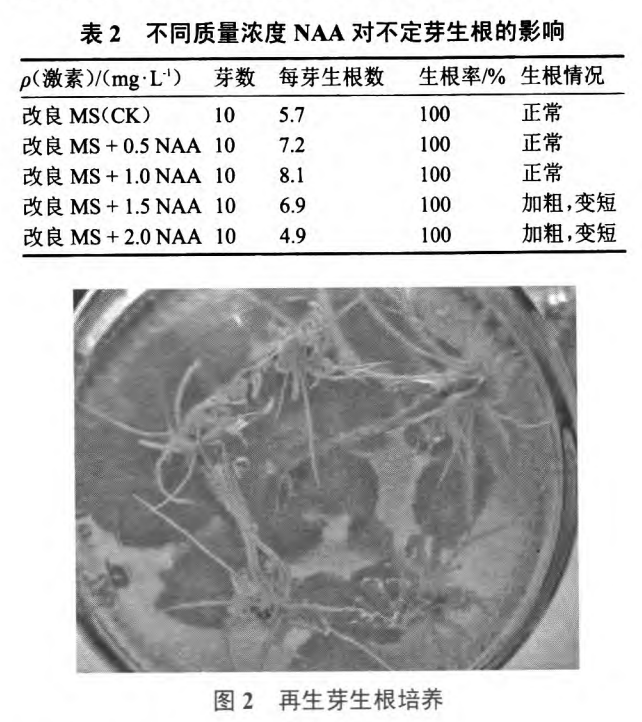
从表2看出,添加生长激素对生根率无影响, 但对生根数有明显促进效果,当NAA质量浓度为 1.0mg·L。1时,生根效果最佳,根数最多且正常,平均 每芽上生根数达到8.1个(图2),激素质量浓度提 高后,根系加粗变短,不利于后续的移栽成活。
3讨论与结论
植物材料的不同品种、不同取材时间、培养基 中激素组成及质量浓度、不同取材部位等均能影响外植体的芽分化频率,其中确定适宜的外植体类型与培养基成分极其浓度最为关键,直接决定着器官分化的模式和程度。。笔者主要探讨植物激素中的6一BA与NAA的质量浓度配比对胚状体芽增殖培养的高效再生影响。一般认为细胞分裂素如6一BA,是有利于芽的分化,而生长素如NAA是有利于根的分化和愈伤组织的形成,细胞分裂素与生长素的比值高有利于芽的分化。添加植物生长激素对生根率并无影响,但对生根数有较明显促进效果,激素超过适宜浓度后,再生苗根系加粗变短,不利于移栽成活。
试验的最终目的是稳定获得正常植株,但在诱导生根的过程中,再生苗玻璃化现象比较严重。造成玻璃化苗的原因有很多,如培养基的水分含量过高、外植体中乙烯含量过高等。由试验结果可知,过高的6.BA浓度是导致再生苗玻璃化的原因之一。通常降低玻璃化频率的方法是提高培养基的渗透压如加入活性炭,以及降低激素的使用浓度。植物细胞在离体培养过程中会产生大量乙烯,尤其是在密闭的培养容器中,乙烯的大量累积会直接影响外植体生长和芽分化。AgN03对许多植物的形态发生有促进作用。一般认为,Ag+作为一种乙烯抑制剂并非抑制乙烯的合成,而是通过促进多胺的合成来提高体细胞胚胎和芽的发生频率。据报道,在用外植体诱导不定芽的培养基中添加适量AgNO3,可显著提高芸薹属植物离体培养条件下芽的再生频率。






